


肝细胞癌(HCC)是一种高度异质性和免疫抑制性的恶性肿瘤,对免疫治疗反应较差,主要由于肿瘤微环境中髓系来源的抑制细胞(MDSCs)介导的免疫逃逸。尽管MDSCs靶向策略备受关注,但如何选择性调控MDSCs的功能并增强免疫治疗效果仍面临挑战。近年来,纳米药物递送系统(如siRNA载体)的发展为精准治疗提供了新思路,但传统脂质体递送系统存在靶向性不足和脱靶风险等问题。本研究设计了一种pH响应性脂质纳米颗粒(Lip@si-YTHDF2),用于靶向递送YTHDF2 siRNA,旨在抑制MDSCs功能,阻断肿瘤干细胞(CSCs)介导的免疫逃逸,进而加强HCC免疫治疗效果。
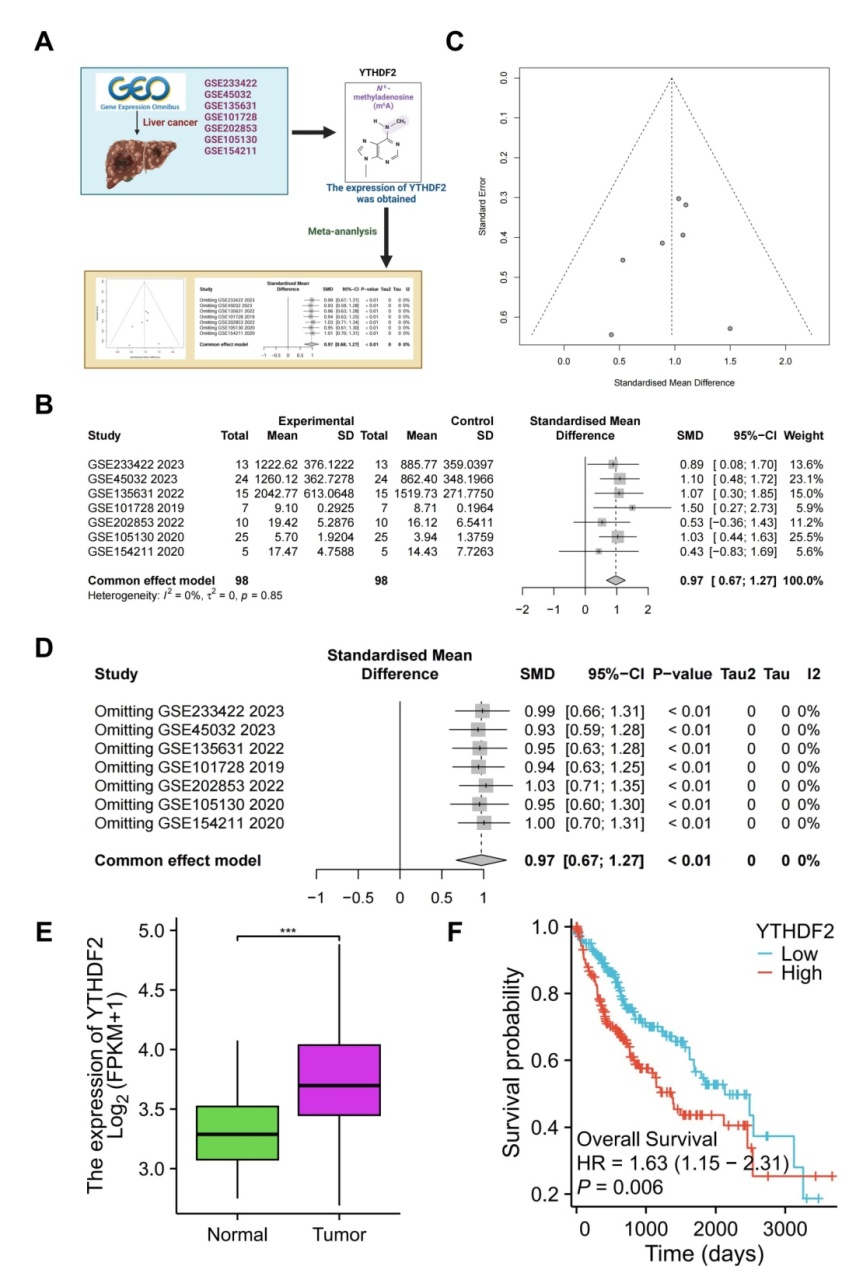
图1 YTHDF2在HCC进展中的作用及其潜在临床意义
通过对GEO和TCGA-LIHC数据库进行生物信息学分析,发现YTHDF2在HCC中高表达且与不良预后显著相关。在敲除YTHDF2小鼠模型中,YTHDF2通过m6A修饰稳定MYC mRNA,从而调控MDSCs活性并促进肿瘤发展。进一步研究表明,Lip@si-YTHDF2能有效下调MYC表达,减弱MDSCs的免疫抑制表型,恢复T细胞介导的抗肿瘤免疫,并与PD-1检查点阻断联合显著抑制肿瘤生长。该研究不仅揭示了YTHDF2/m6A/MYC轴在免疫逃逸中的关键作用,还开发了一种具有临床转化潜力的siRNA递送平台,为改善HCC免疫治疗提供了新策略。
研究成果以“Targeting YTHDF2 with pH-responsive siRNA nanoparticles suppresses MYC m6A modification and restores antitumor immunity in hepatocellular carcinoma”为题,发表在国际期刊《Journal of Nanobiotechnology》(中科院一区TOP,JCR1区,5年影响因子IF=11.4)。论文第一单位为广西师范大学生命科学学院,我院郭子琦博士为论文第一作者,杨程副教授为论文通讯作者,杨程课题组研究生黄秋玲等参与了研究工作。本研究获得了国家自然科学基金、广西自然科学基金等项目的资助。
全文链接:https://doi.org/10.1186/s12951-025-03538-0。


 桂公网安备45030502000260号)
桂公网安备45030502000260号)